Step 3 of 8
Echocardiographie des prothèses
Aspects échocardiographiques 2D
Le matériel prosthétique cause de nombreux artéfacts parce que certains composants absorbent les ultrasons (non-visibilité) et d’autres les réfléchissent (échogénicité extrême). La présence de matériel étranger crée des zones d’ombre ou des images lacunaires (dropout) et provoque de nombreuses reverbérations. La progression des ultrasons est plus lente ou plus rapide que dans les tissus selon le type de matériaux utilisés ; ces variations donnent des images déformées (plus longues ou plus courtes) ou déplacées (plus profondes ou plus proches) des structures.
Les ailettes et les valvules s’ouvrent et se ferment normalement très vite. Leur course va d’une extrémité à l’autre de la position fermée à la position ouverte. En court-axe, les valves biologiques apparaissent rondes lorsqu’elles sont ouvertes et en étoile à 3 branches lorsqu’elles sont fermées; en long-axe, on aperçoit l’anneau, deux picots parallèles à l’axe du flux et la zone de coaptation des valvules en aval de l’anneau. Les doubles ailettes mécaniques ont une course de 60-70° en forme de "V" inversé. On ne peut juger de leur fonctionnement que si l’on voit les deux ailettes bouger simultanément dans le même plan (Figure 11.42). Si l'on n'aperçoit qu'une seule ailette, il est impossibe de savoir si l'autre fonctionne correctement; seul le gradient transvalvulaire peut apporter un renseignement: s'il est normal pour la prothèse et la situation hémodynamique, il est probable que la valve s'ouvre de manière satisfaisante. D'autre part, le flux couleur renseigne sur la qualité de l'occlusion: l'absence de fuite intravalvulaire importante assure que la fermeture soit étanche. Le fait de voir une ailette sous un angle et l'autre sous un autre angle ne doit aucunement rassurer, car on peut fort bien apercevoir la même sous deux angles différents.
Figure 11.42: Images ETO de prothèses valvulaires. A: bioprothèse en position aortique (vue court-axe 50°). Fermée en diastole, elle présente une image analogue à celle d'une valve normale avec ses 3 feuillets en position anatomique; en systole, elle offre une ouverture circulaire facile à planimétrer. B: prothèse mécanique en position mitrale (vue mi-œsophage 30°). Ouverte en diastole, les 2 ailettes sont pratiquement parallèles au flux sanguin; en systole, les ailettes viennent en butée contre la monture et conservent un certain angle avec le plan de l'anneau.
Les prothèses mitrales à double ailette sont en général placées en position anti-anatomique, avec l'axe des ailettes perpendiculaire à la commissure mitrale, raison pour laquelle le profil dans lequel on aperçoit les deux ailettes de manière symétrique est situé entre 30 et 70° à l'ETO. Ce montage prévient le blocage de ces dernières dans l'appareil sous-valvulaire et améliore le remplissage ventriculaire en dirigeant le flux vers la région postéro-latérale [7]. Pour la valve aortique, l'examen est plus malaisé car les seules vues dans l’axe de la prothèse sont transgastriques profondes à 0-20° ou 100-140°; les ailettes sont orientées en fonction des ostia coronariens. Les valves biologiques sans monture et les homogreffes ressemblent à une valve naturelle, à l’exception d’un épaississement et/ou d’un double contour de la paroi aortique. Les valves à double ailette ont peu d’inertie et s’ouvrent complètement même à bas débit. Les bioprothèses montées ont des cuspides plus rigides, particulièrement celles constituées de péricarde bovin ou porcin, et ne s’ouvrent que partiellement si le volume systolique est faible.
La valve doit être immobile par rapport aux structures qui l’entourent. Un mouvement de bascule avec chaque cycle cardiaque laisse supposer un descellement et une déhiscence. En position mitrale, toutefois, la conservation de l'appareil sous-valvulaire et de la base des feuillets peut donner une certaine mobilité à la prothèse [15]. Une cavité péri-annulaire sans écho fait penser à une déhiscence, à un abcès ou à une fistule [6]. Des éléments de l’appareil sous-valvulaire, une thrombose ou un pannus inflammatoire peuvent bloquer une ailette ; le mouvement d’ouverture est alors asymétrique et la fermeture incomplète. Les valves biologiques ont tendance à dégénérer à partir d’une douzaine d’années ; elle se fibrosent et se calcifient, ce qui entraîne une sténose, ou elles se fragmentent et se déchirent, ce qui occasionne des fuites. Après remplacement valvulaire mitral (RVM), il est fréquent de déceler dans l’OG des filaments de fibrine (fibrin strands), qui apparaissent comme des structures filiformes peu échogènes de quelques millimètres qui ondulent dans le flux au voisinage de la prothèse. Après remplacement valvulaire aortique (RVA), on en rencontre quelquefois dans la CCVG. Ces éléments sont probablement constitués de collagène. Les fils de suture s’en différencient pas leur rigidité et leur très forte échogénicité. Après un RVA, la racine de l'aorte est en général épaissie et déformée par un hématome qui se fibrose ultérieurement, mais ce manchon peut faire croire à un abcès péri-aortique. Il se résorbe en 3-6 mois.
Aspects du flux Doppler
Au Doppler spectral, le flux est ceinturé par les deux clics d’ouverture et de fermeture de la prothèse ; ce sont deux bandes très denses mais très brèves, qui sont particulièrement bien visibles avec les prothèses mécaniques. Le flux au Doppler couleur est accéléré dans les prothèses. Sa configuration correspond au profil particulier de chaque type de valve : flux tourbillonnaire autour de la bille dans les valves de Starr, flux turbulent oblique dans les valves monodisques, flux laminaire accéléré à travers les bioprothèses et les valves à double ailette. Dans ces dernières, le flux est plus rapide dans la fente située entre les deux ailettes que dans les deux ouvertures latérales (voir Figure 11.36).
Au Doppler couleur, les prothèses valvulaires présentent plusieurs types de régurgitations d’importance et de configuration variable selon les modèles [1].
- Bien que souvent étanches, les valves biologiques présentent de petites fuites en général centrales mais parfois au niveau des commissures.
- Les valves mécaniques ont physiologiquement de multiples jets de régurgitation bien visibles au Doppler couleur ; ils sont fins et mesurent 1 cm (prothèse aortique) à 2 cm (prothèse mitrale) de longueur. Leur origine est clairement à l’intérieur de l’anneau. Ces fuites d’autolavage représentent une fraction de régurgitation de ≤ 5% et sont destinées à empêcher le dépôt de fibrine sur les ailettes en pyrolocarbone (Figure 11.43) [13].
- La rapidité de fermeture des ailettes déplace un certain volume de sang en amont de la prothèse (closure backflow) ; celui-ci peut apparaître comme un flash protosystolique de courte durée ; il ne correspond pas à une fuite.
- Les fuites paravalvulaires sont situées entre la prothèse et l’anneau anatomique ; elles sont toujours pathologiques (voir plus loin Fuite paravalvulaire).
Figure 11.43 : Fuites intravalvulaires d’autolavage. Ce type de fuite situé à l’intérieur de l’anneau de la prothèse est normal. Il varie selon les types de valves mécaniques, à la fois en nombre et en importance, mais l’insuffisance est toujours minime (fraction de régurgitation ≤ 5%). Dans les valves bi-ailette, les jets périphériques sont légèrement concentriques, alors que les jets situés sur les pivots sont en bouquet. Ils sont toujours fins et ne présentent jamais de zone d’accélération concentrique sur le versant ventriculaire (image ETO 2-cavités à 90° d’une valve St.Jude en position mitrale).
Gradients de pression
Toutes les prothèses sont restrictives par rapport aux valves natives normales. Leur surface d’ouverture varie de 1.1 cm2 (bioprothèse aortique 19) à 3.5 cm2 (valve mécanique mitrale 33). De ce fait, le gradient de pression (ΔP) est significatif ; le gradient moyen varie de 4 mmHg (StJude mitrale) à 12-20 mmHg (bioprothèse aortique) (Tableaux 11.7, 11.8 et 11.9) [8,9,12,15]. A taille égale, les gradients vont par ordre croissant : autogreffes < homogreffes < bioprothèses non-montées (stentless) < valves mécaniques < bioprothèses montées. On peut facilement surestimer le gradient d’une prothèse, donc sous-estimer sa surface, à cause de plusieurs phénomènes [15].
- Le Doppler calcule le ΔP à partir de la Vmax, qui correspond au point le plus rétréci du flux (vena contracta); cette zone est en général très courte (1-3 mm) et la pression ré-augmente rapidement dans la chambre d'aval (Figure 11.44). Le gradient excessif mesuré au Doppler tend à sous-estimer la surface d'ouverture réelle dans les petites prothèses et dans les grandes aortes. De ce fait, le gradient moyen est un meilleur critère que le gradient maximal [14].
- La géométrie des prothèses induit un phénomène de récupération de pression (pressure recovery) : la pression baisse lorsque la vélocité augmente dans la zone rétrécie, mais l'énergie cinétique est retransformée en pression dès que le flux ralentit au-delà du rétrécissement [11]. A travers une prothèse aortique de petite taille (19-21 mm), ce phénomène peut représenter une diminution jusqu'à 20% par rapport au gradient de pression mesuré à l'écho [2]. Comme la perte d'énergie cinétique dans les tourbillons diminue l'importance de la récupération de pression, le phénomène est moins marqué lorsque l'aorte est beaucoup plus grande que la prothèse parce qu'il y a davantage de tourbillons.
Figure 11.44 : Illustration de l’équation de continuité et du phénomène de récupération de pression. L’équation de continuité exprime la loi de la conservation de l’énergie cinétique ; lorsque la vitesse accélère, la pression baisse, et inversement. La Vmax est atteinte juste distalement au rétrécissement (appelé vena contracta à cause de la contraction du flux) ; c’est là que la pression est la plus basse et le gradient de pression maximal. La pression est récupérée distalement (pr, pressure recovery) au fur et à mesure que la vélocité baisse parce que le conduit s’élargit ; la récupération n’est pas totale à cause de la perte de charge provoquée par les forces de friction et par la formation de tourbillons (vortex) [14].
- Le gradient est mesuré avec l’axe du Doppler au milieu de la valve dans les prothèses biologiques, mais dans l’un des deux larges orifices latéraux dans les valves à double ailette, car il est augmenté de 40% dans la partie centrale.
- Après un RVA pour sténose, la vélocité dans la chambre de chasse du VG est fréquemment supérieure à 1.5 m/s à cause de l'HVG et de la chute de postcharge pour le ventricule. Il est alors impératif d’utiliser l’équation modifiée de Bernoulli ΔP = 4 • (V2VAo – V2CCVG) et non sa version simplifiée (ΔP = 4 • V2). Omettre la soustraction de la Vmax dans la CCVG conduit à une surestimation du gradient de 9 à 30 mmHg. A l’affichage spectral, le flux de sténose dynamique de la CCVG présente une forme en dague et un pic de vélocité télésystolique, alors que celui de la sténose fixe de la prothèse montre un pic de vélocité protosystolique (voir Figure 11.115).
- Pour le calcul de l'équation de continuité, la mesure du diamètre de la CCVG est délicate à cause de la brillance et des ombres de la prothèse; de plus, les vues ETO ne permettent que de mesurer le petit diamètre de la CCVG qui est de section ovale et non circulaire. Ceci conduit à une sous-estimation de la surface valvulaire.
- En sortant de CEC, le flux est accéléré à cause de la stimulation catécholaminergique et de l’augmentation momentanée du volume systolique (transfusion, haut débit, hémodilution, extrasystolie). D'autre part, une basse pression dans la racine de l’aorte (vasoplégie, contre-pulsion intra-aortique, anévrysme de l’aorte ascendante) augmente le gradient d’une prothèse aortique par diminution de la pression d’aval; avec la CPIA, cette différence est de l’ordre de 30-40 mmHg. Dans ces situations, la vélocité artificiellement accélérée à travers la prothèse tend à sous-estimer sa surface réelle.
- Lorsque différents plans d'examen donnent des valeurs de vélocités différentes, la fenêtre qui donne les vélocités les plus élevées est la plus fiable.
Au niveau aortique, on peut éliminer les interférences des variations de flux et de volume systolique est utilisant le rapport (R) entre l’intégrale des vélocités (ITV) dans la CCVG et l’ITV à travers la valve :
R = ITVCCVG / ITVVAo.
Ce rapport, aussi appelé indice de perméabilité, quantifie l'accélération du flux au niveau de la prothèse où le diamètre est plus étroit (voir Figure 11.30). Normalement, il voisine 0.5 – 0.7; il doit rester supérieur à 0.4, sans quoi la prothèse est sténosante; une valeur < 0.25 représente une sténose serrée [15]. Il permet également de différentier une élévation du gradient due à un grand volume systolique (hypervolémie, haut débit, sepsis, anémie, IA) de celle due à une sténose, car il reste normal dans le premier cas; en effet, l'augmentation de la vélocité est identique dans la CCVG et à travers la prothèse.
D’une manière générale, le gradient moyen a une valeur plus pertinente que le gradient maximal parce qu’il dépend moins des conditions hémodynamiques instantanées [4]. De plus, le gradient moyen calculé à l’échocardiographie a une bonne corrélation avec le gradient moyen angiographique, alors que le gradient Doppler maximum instantané est en général supérieur au gradient maximum pic-à-pic du cathétérisme (voir Figure 11.28) [11].
La découverte d'un gradient excessif à travers une prothèse (ΔP moyen > 15-20 mmHg en position aortique, ΔP moyen > 5-7 mmHg en position mitrale) ne signifie par obligatoirement que celle-ci dysfonctionne. Certaines données permettent d'éclaircir la situation [9].
- S'assurer que le gradient est mesuré dans les orifices latéraux des valves à double ailette, car la vélocité est plus élevée de 40-50% à travers la fente centrale.
- En position aortique, mesurer la Vmax dans la CCVG et faire le rapport VCCVG /VVAo; s'il est > 0.4, le fonctionnement valvulaire est normal.
- Evaluer s'il existe une discordance entre la taille de la prothèse et la surface corporelle du patient; si la surface de la prothèse est < 0.85 cm2/m2 en position aortique ou < 1.2 cm2/m2 en position mitrale, la taille de la valve est insuffisante pour le débit cardiaque du patient (voir Complications des prothèses, Discordance patient-prothèse).
- Evaluer l'importance d'une éventuelle insuffisance valvulaire qui augmente le volume systolique ou diastolique.
- Confronter les mesures échocardiographiques avec les mesures hémodynamiques: existe-t-il une hypotension artérielle aortique (CPIA), un volume systolique élevé (Swan-Ganz, PiCCO), un excès de catécholamines β (débit cardiaque) ?
- En dernier recours, mesurer le gradient pic-à-pic à l'aiguille entre le VG et l'aorte ascendante en cas de RVA, ou entre le VG et l'OG en cas de RVM.
Surface d’ouverture
En position aortique, l’équation de continuité (SAo = (SCCVG • ITVCCVG) / ITVAo) permet d’estimer la surface de la prothèse en tenant compte du flux transvalvulaire, mais elle bute sur 3 problèmes : 1) la mesure du diamètre de la CCVG est délicate à cause de la brillance et des ombres de la prothèse, 2) la surface de la valve n'est pas circulaire, et 3) la vélocité est artificiellement accélérée à travers la prothèse, ce qui tend à sous-estimer sa surface réelle [3]. L'équation n’est valide qu’en l’absence d’insuffisance aortique et d’insuffisance mitrale. Comme déjà mentionné, le rapport ITVCCVG/ITVVAo permet d’échapper à ces problèmes ; plus il est élevé, plus la surface est grande. En position mitrale ou tricuspidienne, le temps de demi-pression (220/Pt1/2) ne s'applique qu'aux valves dont la surface est < 1.5 cm2; en-dehors de ce domaine, il surestime l’ouverture réelle de la prothèse [4,15]. L'utilisation de la taille nominale de la prothèse pour calculer sa surface d'ouverture n'a malheureusement aucune validité, car la valeur affichée relève de mesures qui varient selon les fabricants [15].
Les valeurs normales de gradient de pression, de vélocité de flux et de surface d'ouverture des nombreuses prothèses actuellement sur le marché varie selon les modèles et selon les tailles. Les données de référence sont publiées en annexe à la référence 15 (voir Directives Valves prothèses.pdf). Le site en libre accès www.valveguide.ch fournit les données de toutes les prothèses actuellement en usage [5].
| Prothèses valvulaires |
|
Les matériaux prothétiques absorbent les ultrasons (zones d’ombre) ou les réfléchissent (réverbérations)
Mouvement des ailettes (prothèses mécaniques)
- Les 2 ailettes doivent être visibles sur la même image
- Valve mitrale : vue mi-oesophage 40-80°
- Valve aortique : vue transgastrique 0° ou 120°
Mouvement des cuspides (prothèses biologiques)
- Valve mitrale : vue 4-cavités 0° - 2-cavités 90°
- Valve aortique : vue court-axe 40°
Les prothèses mécaniques présentent des fuites d’autolavage normales (FR 5%) ; les prothèses biologiques présentent des fuites facultatives, de localisation variable
Les prothèses sont restrictives par rapport à une valve native normale, par ordre croissant de gradient de pression (ΔP) : autogreffes < homogreffes < bioprothèses non-montées (stentless) < valves mécaniques < bioprothèses montées (ΔPmax 5 – 40 mmHg)
Le gradient de pression augmente en cas de : bioprothèse montée, petite taille, position aortique, haut débit cardiaque, hypervolémie, vasoplégie, CPIA
En position aortique, le ΔP doit impérativement être calculé avec l’équation de Bernoulli complète : ΔP = 4 • (V2VAo - V2CCVG). Après RVA, le rapport VCCVG /VVao doit être > 0.4; une valeur plus basse indique une sténose.
Le phénomène de récupération de pression (pressure recovery) est majeur dans les valves mécaniques
|
Examen ETO post-CEC
Après remplacement valvulaire mitral (RVM), aortique (RVA) ou tricuspidien (RVT), la condition fondamentale pour que l’examen soit pertinent est d’en interpréter les données en fonction de l’hémodynamique du patient.
- L’ouverture et la fermeture des ailettes et des cuspides sont incomplètes sous assistance par la machine de CEC.
- L’hypovolémie, l’hémodilution et le bas débit cardiaque diminuent les vélocités et les gradients ; la surface réelle est surestimée par l’équation de continuité.
- L’hypervolémie et la stimulation inotrope augmentent les vélocités et les gradients ; l’équation de continuité sous-estime la surface.
- La contre-pulsion intra-aortique (CPIA) augmente très fortement le gradient maximal à travers la valve aortique parce que la pression est très basse dans l’aorte ascendante en protosystole ; à un moindre degré, la vasoplégie a le même effet.
- La tachycardie limite le flux à travers les valves auriculo-ventriculaires par raccourcissement de la diastole.
- Les arythmies perturbent l'évaluation des prothèses. La FA oblige à moyenner les mesures de plusieurs cycles cardiaques dont la durée correspond à une fréquence de 60-80 batt/min.
L’examen commence par une évaluation de la performance ventriculaire (VG et VD) et de la volémie. Cet aspect est prioritaire pendant la mise en charge. L’examen détaillé de la prothèse n’a de sens que lorsque l’hémodynamique du patient est stabilisée. L’échogénicité marquée du matériel prothétique bloque la vision des ventricules en vues mi-oesophagiennes; seules les vues trans-gastriques peuvent renseigner correctement sur la fonction et le remplissage.
L’examen de la prothèse se base sur l’imagerie 2D, le Doppler couleur et le calcul des gradients. Les vues bidimensionnelles mettent en évidence l’ouverture/fermeture de la prothèse.
- Prothèse mécanique bi-ailette : mouvements simultanés des 2 ailettes sur la même image, en vue mi-oesophagienne 30-80° (prothèse mitrale) ou transgastrique 0° et 120° (prothèse aortique). La vue simultanée des 2 ailettes est la seule preuve bidimensionnelle que la prothèse fonctionne correctement. Ne voir qu’une ailette dans deux plans différents, même si l’orientation de l’ailette est différente, n’exclut pas qu’on aperçoive en fait deux fois la même ailette et que l’autre reste invisible. La confirmation est apportée par le flux couleur (double passage par les deux grands orifices) et le calcul des gradients. En position mitrale, on parvient toujours à trouver un plan où les 2 ailettes apparaissent en même temps. En position aortique, l’image dépend de l’orientation de la prothèse; il se peut que la vue des 2 ailettes soit impossible.
- Prothèse biologique : mouvements des cuspides en vue rétrocardiaque 0-90° (bioprothèse mitrale) ou court-axe 40° (bioprothèse aortique) ; mesure de la surface d’ouverture par planimétrie en court-axe 40° (bioprothèse aortique).
- Il est normal de voir un manchon autour de la racine aortique après RVA (hématome, thrombus, suture).
- Présence de fils de suture, recherche d’éventuels thrombus et filaments de fibrine.
Plusieurs complications sont immédiatement détectables par l’ETO.
- Blocage d’une ailette : absence de mouvement et de flux sur la moitié de la prothèse, gradient excessif ; en général causé par l’appareil sous-valvulaire (position mitrale) ou la musculature de la CCVG (position aortique). Ce blocage peut être corrigé par rotation de la prothèse dans son anneau, mais ceci implique un retour en CEC.
- Lors de bioprothèse en position mitrale, le montant antérieur de la valve peut obstruer partiellement la CCVG; mesure de la Vmax dans la CCVG (risque de sténose).
- Après RVM :
- Contrôle de la contraction de la paroi latérale ; des points de fixation de la prothèse au niveau latéral peuvent léser l’artère circonflexe et entraîner une akinésie latérale. En effet, le trajet de la CX dans le sillon auriculo-ventriculaire gauche est à quelques millimètres de l'anneau mitral et les points de fixation latéraux peuvent aisément empiéter sur le vaisseau et l'occlure.
- Les points de fixation au niveau du trigone peuvent causer une restriction de la cuspide non-coronaire ou coronaire gauche de la valve aortique, et déclencher ou aggraver une insuffisance (IA).
- La pire complication chirurgicale qui puisse survenir après chirurgie mitrale est une déchirure de l'anneau et de la base du VG, le plus souvent au cours d'une réopération. La reconstruction en est extrêmement hasardeuse et la mortalité très élevée.
- Après RVA :
- Contrôle du flux dans le tronc commun et dans la coronaire droite.
- Contrôle de la valve mitrale : des points de fixation de la prothèse aortique au niveau du trigone peuvent opérer une traction sur le feuillet antérieur et déclencher une IM ou aggraver une fuite préexistante. En cas de décalcification de l’angle mitro-aortique, une déchirure peut apparaître à la racine du feuillet mitral antérieur.
- La myectomie septale dans la CCVG, qui accompagne souvent le RVA pour sténose aortique et HVG importante, peut être excessive et traverser le septum sous-aortique de part en part, conduisant à une CIV iatrogène. Le flux couleur montre un passage tourbillonnaire systolo-diastolique entre le VG et le VD (Vidéo).
- Bloc AV complet par lésion du faisceau de His dans sa portion jouxtant le septum membraneux en dessous de la cuspide non-coronaire.
- Fuite paravalvulaire, effet CMO, discordance patient-prothèse: voir plus loin et sous Complications des prothèses.
Vidéo: Communication interventriculaire iatrogène après résection excessive de la paroi septale de la CCVG au cours d'un RVA pour sténose aortique; le flux couleur montre le passage gauche-droit.
Le flux couleur est nécessaire pour guider le positionnement du Doppler pulsé/continu dans le flux antérograde et rétrograde. Il démontre les régurgitations.
- Fuites d’autolavage dans les prothèses mécaniques ; leur nombre et leur taille dépend des modèles ; elles sont intravalvulaires et mineures.
- Fuites résiduelles dans les bioprothèses (centrale et/ou aux commissures).
- Fuites paravalvulaires situées à l’extérieur de l’anneau; elles sont toujours pathologiques.
- Fuite mitrale secondaire à une rétraction du feuillet antérieur par les sutures postérieures d’une prothèse aortique.
- Fuite aortique par rétraction de la cuspide non-coronaire ou coronaire gauche par les sutures d’implantation d’une prothèse mitrale.
- Flux de CIV sous-aortique après myectomie excessive de la CCVG.
L’apparition d’une IM après un RVA peut être liée à plusieurs phénomènes différents.
- Réouverture mésosystolique de la valve mitrale sur sténose dynamique sous-aortique (SAM); même importante, cette IM est brêve et ne dure pas toute la systole: elle est méso-télésystolique. C’est souvent le signe d’appel du diagnostic de l’effet CMO (voir Complications).
- Rétraction du feuillet antérieur par des points d’ancrage de la prothèse; la proximité de l’anneau aortique et de l’anneau mitral au niveau du trigone fait que des points un peu larges à cet endroit exercent une traction sur le feuillet antérieur et peuvent l’empêcher d’occlure correctement.
- Dysfonction du VG ; l’IM est un signe d’accompagnement habituel d’une dilatation ou d’une ischémie aiguë du VG.
- Persistence d’une IM présente avant la CEC, qu’elle soit organique (maladie calcifiante, dégénérescence, remaniemens dus à l’âge) ou fonctionnelle (calcifications de l’anneau mitral dysfonction ou dilatation du VG). Le plus souvent, la levée de l’obstacle à l’éjection par le RVA diminue suffisamment le stress de paroi du VG pour que l’IM soit moins importante qu’en préopératoire.
Les gradients varient selon le type de prothèse mais sont toujours supérieurs à ceux d’une valve native normale. Ils varient avec la taille de la valve. De manière simplifiée, on peut prendre les repères suivants pour les gradients moyens et les vélocités maximales (variables selon les tailles) (pour plus de détails, voir Tableau 11.7, Tableau 11.8 et Tableau 11.9) [8,9,12,15].
- En position mitrale :
- Valve mécanique bi-ailette ΔPmoy 3-5 mmHg Vmax 1.2 – 1.6 m/s
- Bioprothèse montée ΔPmoy 6 mmHg Vmax 1.5 – 1.8 m/s
- En position aortique :
- Bioprothèse sans armature ΔPmoy 4-8 mmHg Vmax 1.5 – 1.8 m/s
- Valve mécanique bi-ailette ΔPmoy 6-15 mmHg Vmax 2.0 – 2.5 m/s
- Bioprothèse montée ΔPmoy 12-20 mmHg Vmax 2.5 – 3.0 m/s
En position aortique, il est essentiel de calculer le gradient avec l’équation de Bernoulli prenant en compte la vélocité dans la chambre de chasse ( ΔP = 4 • (V2Ao – V2CCVG) ), car celle-ci est souvent bien au dessus de 1.5 m/s dans les conditions hémodynamiques de sortie de pompe : HVG concentrique, hypovolémie, stimulation catécholaminergique et baisse de postcharge par la levée de la sténose. La sténose sous-aortique dynamique est définie par une Vmax dans la CCVG > 2.5 m/s ; à elle seule, elle induit un ΔPmax > 25 mmHg. Le rapport entre l’ITV dans la CCVG et à travers la valve (R = ITVCCVG / ITVVAo) est utile pour apprécier le degré d’accélération généré par la prothèse.
Toutefois, plusieurs phénomènes peuvent induire un gradient trans-prosthétique faussement élevé à travers une prothèse aortique [10].
- Episode momentané de haut volume systolique : hypervolémie, transfusion trop rapide depuis la machine de CEC, hémodilution.
- La récupération de pression: l'énergie cinétique se retransforme en pression au-delà de la zone d'accélération maximale où la pression est minimale; comme l'échocardiographie mesure la pression précisément par la vélocité maximale, elle a tendance à surestimer le gradient réel (voir Figure 11.44).
- Sténose sous-aortique dynamique (effet CMO) : la levée de l’obstacle à l’éjection peut amener un ventricule hypertrophié à collaber sur lui-même en systole, car sa cavité est naturellement petite et la chambre de chasse très musclée ; le feuillet antérieur de la valve mitrale est déplacé vers la CCVG et y est aspiré au point d'en bloquer partiellement le flux. C'est le SAM (systolic anterior motion), phénomène analogue à celui d'une cardiomyopathie obstructive (CMO) (Figure 11.45). Ce rétrécissement de la chambre de chasse en systole crée une obstruction dynamique qui peut représenter un gradient de 25-40 mmHg en amont de la prothèse (voir Complications des prothèses, Sténose sous-aortique dynamique).
Figure 11.45 : Obstruction dynamique de la CCVG après plastie mitrale. A : un anneau restrictif et/ou une trop grande hauteur du feuillet postérieur (FP) (rapport feuillet antérieur / feuillet postérieur < 1.3) avance la paroi postérieure et projette le point de coaptation vers la CCVG (flèche verte). En protosystole, la coaptation a lieu sur le corps du feuillet antérieur (FA) dont la partie distale se retrouve dans le VG et non en application contre le FP. B : en mésosystole, la pression intraventriculaire pousse le FA en direction de la CCVG ; en cours d’éjection, celui-ci est aspiré par effet Venturi et vient bloquer la CCVG (SAM: systolic anterior motion). Le débit aortique baisse soudainement, et la réouverture de la valve mitrale provoque une insuffisance méso-télésystolique (IM). C : Lorsque le VG se rétrécit, seule la paroi postérieure peut se déplacer antérieurement (flèche rouge) parce que la base du feuillet antérieur est accolée au trigone fibreux qui est un point fixe puisqu’il est le squelette et le centre mécanique du cœur.
- Même sans sténose musculaire, la vélocité dans la chambre de chasse du VG peut dépasser 1.5 m/s à cause d’une stimulation sympathique importante et d’une hypervolémie passagère. Dans ce cas, l’équation de Bernoulli doit être rectifiée en tenant compte de la Vmax dans la CCVG : ΔP = 4 (V22 –V12), où V2 est la Vmax à travers la prothèse et V1 la Vmax de la CCVG. Le gradient créé dans la CCVG est ainsi soustrait du gradient total pour obtenir celui qui est propre à la prothèse (voir Figure 11.121).
- La présence d'une contrepulsion intra-aortique (CPIA) abaisse considérablement la pression dans l'aorte ascendante en début de systole lorsque le ballon se dégonfle; il s'ensuit un gradient exagéré entre le VG et l'aorte; il faut mesurer le gradient pendant un arrêt momentané de la CPIA. Une dilatation importante de l’aorte ascendante a le même effet.
- Défaut d'appariement entre la taille de la prothèse et celle du patient (patient-prosthesis mismatch): une surface d'ouverture < 0.85 cm2/m2 crée un gradient excessif (voir Complications des prothèses, Discordance patient-prothèse).
Fuite paravalvulaire
La fuite paravalvulaire (FPV) est située à l’extérieur de l’anneau prothétique. Elle est toujours pathologique, mais son impact varie selon son importance.
- Les petites fuites (degré ≤ I) ne sont pas significatives ; en général, elles disparaissent rapidement avec la protamine ou en quelques jours avec le dépôt de fibrine et l’endothélialisation.
- Des fuites peu importantes sont inévitables lorsque l’anneau valvulaire est très calcifié et que la congruence avec l’anneau prothétique est impossible.
- Au niveau tricuspidien, il arrive que le chirurgien ne fixe pas la prothèse du côté septal pour éviter de léser le faisceau de His, ce qui laisse un orifice extra-annulaire.
- Les fuites modérées-à-sévères (50% des cas) doivent être corrigées pour autant que cela soit faisable, car elles tendent à s’aggraver avec le temps et à provoquer une hémolyse significative.
- La tolérance vis-à-vis des FPV est plus grande pour les fuites aortiques que pour les fuites mitrales, car la vélocité est moins élevée et le risque d’hémolyse moins grand en position aortique. La tolérance est très élevée pour les FPV tricuspidiennes dont la vélocité est basse.
Les fuites paravalvulaires importantes présentent des signes caractéristiques (Vidéo et Figure 11.46).
- Passage libre localisable en imagerie 2D à l’extérieur de l’anneau (signe inconstant).
- PISA sur la face d’amont.
- Passage visible au Doppler couleur autour de l’anneau valvulaire.
- Vena contracta ≥ 0.3 cm.
- Large flux tourbillonnaire d’aval, souvent excentrique.
- Prothèse mitrale : rechercher les FPV sur tout le pourtour de la prothèse en plaçant la fenêtre couleur au niveau de l’angle mitro-aortique en vue 4-cavités et en tournant l’angle du capteur de 0° à 180° tout en maintenant la fenêtre sur la partie gauche de la prothèse à l’écran. Placer ensuite la fenêtre de l’autre côté de la valve et revenir de 180° jusqu’à 0° en maintenant la fenêtre sur le bord droit de la prothèse à l’écran.
- Prothèse aortique : rechercher les FPV en long-axe mi-œsophage 120° et transgastrique 0° - 120°; les localiser en court-axe 40° en périphérie de l’anneau (tourbillons diastoliques).
- L'imagerie 3D avec reconstruction d'une vue "en-face" de la valve permet de mesurer l'étendue de la, ou des, fuite(s) paravalvulaire(s). Une fuite sévère représente > 20% de la circonférence de la valve (fuite modérée : 10-20%, fuite mineure : < 10%) (Figure 11.47) [15].
Vidéo: fuite paravalvulaire postérieure majeure tournoyant dans l'OG, accompagnée d'une petite fuite intravalvulaire normale.
Figure 11.46 : Fuites valvulaires (FPV). A et B : fuites normales d’autolavage d’une prothèse mécanique bi-ailette en position mitrale ; jets fins, intravalvulaires, parallèles ou en bouquet, pas de zone d’accélération C : schéma montrant que la fuite paravalvulaire est située entre l’anneau de la prothèse et l’anneau anatomique de la valve (*), alors que les fuites d’autolavage (FAL) sont à l’intérieur de la valve. Une FPV importante présente une zone d’accélération concentrique (PISA) sur le versant ventriculaire. D : FPV aortique en court-axe ; deux fuites situées autour de l’anneau prothétique (flèche) à 3 heures et à 7 heures ; persistance d’un flux en diastole par les orifices paravalvulaires. E : FPV mitrale antérieure ; une petite fuite physiologique est visible à l’intérieur de l’anneau prothétique (flèche). F : FPV mitrale postérieure.
Figure 11.47 : Fuite paravalvulaire (FPV). A : orifice de régurgitation para-annulaire à l’extérieur d’un anneau de Carpentier après plastie mitrale (vue ETO 3D depuis l’OG). B : occlusion d’une fuite paravalvulaire par un dispositif utilisé pour la fermeture de CIA. Deux dispositifs sont en place (occluders), l’un étant encore suspendu à son guide (vue ETO 3D depuis l’OG).
La localisation d’une fuite paravalvulaire en imagerie bidimensionnelle n’est pas toujours aisée, mais elle est facilitée par une observation très systématique.
- Après RVM : recherche sur tout le pourtour de la prothèse ; les vues 4-cavités 0°, bicommissurale 60°, 2-cavités 90° et long-axe 120-140° déterminent 4 plans qui visualisent huit quadrants de l’anneau (Figure 26.65) ; la position de l’appendice auriculaire gauche, de la valve tricuspide et de la valve aortique sont des repères supplémentaires.
- Après RVA: la vue court-axe 40° de la prothèse aortique permet de voir où se trouve la fuite en diastole sur le pourtour de l’anneau prothétique (Figure 11.46D).
Figure 26.65 : Les 4 plans transoesophagiens standards permettent de définir huit quadrants de l’anneau mitral, ce qui assure une localisation efficace d’une fuite paravalvulaire ; l’appendice auriculaire gauche (AAG), la valve aortique et la valve tricuspide sont des repères supplémentaires. Les plans orthogonaux de l’organisme (0° et 90°) sont en rouge et les plans orthogonaux de la valve mitrale en vert (60° et 120-140°).
La localisation des fuites est très importante, car le chirurgien peut avoir de la peine à mettre en évidence l'orifice dans le champ opératoire lorsque le cœur est flaccide; de plus, la brèche est en général située sous l'anneau prothétique. La décision de retourner en CEC pour occlure l’orifice paravalvulaire n’est pas fondée que sur l’image ETO mais sur une série de contingences : valve incriminée, état de l’anneau, faisabilité chirurgicale de la réparation, risque clinique d’une 2ème CEC, etc. Si la chirurgie est trop risquée, il est possible de réduire ultérieurement une fuite paravalvulaire au moyen d’un dispositif d’occlusion utilisé pour fermer les CIA (occluder type Amplatzer™).
Examen d'une prothèse aortique
Une prothèse aortique normale donne une image de sténose légère, avec une Vmax > 2 m/s et un gradient de pression moyen de 6 à 20 mmHg selon le type de prothèse et selon sa taille (voir ci-dessus). L'image spectrale du flux Doppler continu présente une forme triangulaire avec un pic précoce (durée d'accélération < 80 msec) et un rapport ITVCCVG/ITVVAo ≥ 0.4. La surface d'ouverture calculée par l'équation de continuité (SAo = (SCCVG • ITVCCVG) / ITVAo) est en général ≥ 1.5 cm2, mais elle doit être référencée au type de valve concerné. Lorsque la prothèse est sténosante, la Vmax dépasse 3-4 m/s et le gradient moyen 30 mmHg. Le flux prend une allure arrondie avec un pic de vélocité mésosystolique (durée d'accélération > 100 msec) (Figure 11.48). Un rapport ITVCCVG/ITVVAo < 0.25 et une surface d'ouverture < 1 cm2 signent une sténose serrée inacceptable [15]. Comme ces mesures peuvent conduire à une reprise en CEC, il est capital de tenir compte de la fonction du VG. Une défaillance gauche se traduit par une durée d'accélération allongée, mais une Vmax abaissée et un gradient diminué qui peuvent laisser supposer que la prothèse présente une surface d'ouverture suffisante. Au contraire, un VG hyperdynamique entraine un excès de vélocité et de gradient, mais avec une durée d'acélération brève et un rapport ITVCCVG/ITVVAo > 0.4.
Figure 11.48 : Images spectrales du flux Doppler continu en cas de sténose aortique (position transgastrique). A: Flux d'une sténose aortique mineure avec un temps d'accélération court (< 30% de la durée d'éjaction), une forme triangulaire et un pic protosystolique. B: Flux d'une sténose aortique serrée avec un flux arrondi, un temps d'accélération long (> 40% de la durée d'éjection) et un pic mésosystolique.
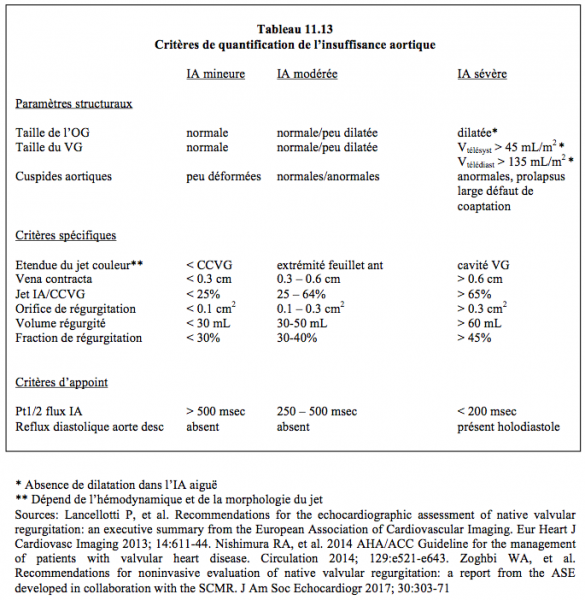
La présence d'un jet diastolique tourbillonnant dans la CCVG alerte sur la probabilité d'une régurgitation. La quantification d'une fuite résiduelle n'est pas aisée en vues mi-œsophage long-axe ou court-axe à cause de l'ombre portée par l'armature de la prothèse sur la chambre de chasse et sur les feuillets. Bien que la valve y soit plus éloignée du capteur, les vues transgastriques profonde à 0° ou long-axe à 120° sont plus adéquates pour mesurer le diamètre la vena contracta (critères identiques à ceux d'une fuite dans une valve native, voir Tableau 11.13). Outre l'évaluation de l'importance de l'insuffisance, la question de son origine intra- ou para-valvulaire est capitale, mais pas toujours aisée à résoudre. Dans le premier cas, la fuite est en général centrale, alors que dans le second elle est plutôt excentrique, mais le prolapsus d'une prothèse stentless mal ajustée peut également occasionner une fuite excentrique bien qu'intravalvulaire. La présence d'une zone d'accélération concentrique (PISA) en amont de la prothèse parle pour une fuite importante.
Examen d'une prothèse mitrale
Une prothèse mitrale normale présente une Vmax ≤ 1.9 m/s (valve mécanique) à ≤ 2.4 m/s (bioprothèse) et un gradient moyen ≤ 5 mmHg. Le temps de demi-pression (Pt1/2) n'est applicable que lorsque la surface est sténosée (≤ 1.5 cm2); il ne permet pas le calcul de la surface d'ouverture dans les prothèses. L'équation de continuité est préférable, en prenant pour référence le volume systolique dans la CCVG pour autant qu'il n'y ait ni insuffisance aortique ni insuffisance mitrale: SVmitr = (SCCVG • ITVCCVG) / ITVVMitr. Le rapport entre l'intégrale des vélocités à travers la prothèse mitrale et l'intégrale des vélocités dans la CCVG (ITVVMitr / ITVCCVG) est l'inverse du rapport utilisé pour la valve aortique, mais il remplit la même fonction: mesurer le rétrécissement mitral indépendamment des conditions hémodynamiques; il est normalement < 2.2 (≥ 2.5 en cas de sténose sévère) [4]. Toutes ces mesures présupposent que le status hémodynamique est normal, la volémie adéquate et la fréquence cardiaque stable.
Une insuffisance excessive est en général causée par le blocage partiel d'une ailette par l'appareil sous-valvulaire ou par une fuite paravalvulaire. Les critères pour considérer l'IM prothétique comme sévère et nécessitant une réintervention sont une surface de l'orifice de régurgitation ≥ 0.5 cm2, un volume régurgité ≥ 60 mL, un large PISA et un jet recouvrant > 40% de la surface de l'OG. La fuite est considérée comme mineure si la surface de l'orifice de régurgitation est < 0.2 cm2, le volume régurgité < 30 mL, le PISA minime ou absent, et si le jet recouvre < 20% de la surface de l'OG [15]. Le fort gradient de pression entre le VG et l'OG en systole et l'écoulement du jet de régurgitation contre du matériel prothétique donnent lieu à une forte hémolyse à long terme, allant jusqu'à des transfusions itératives. Ce phénomène est un fort argument en faveur d'une réintervention ultérieure.
Examen d'une prothèse tricuspidienne
Le flux à travers la tricuspide est hautement dépendant de la ventilation, ce qui oblige à procéder à toutes les mesures en apnée. La Vmax du flux E est d'environ 1.0 m/s et le gradient moyen de 2-3 mmHg dans une prothèse fonctionnant normalement. La prothèse est considérée comme sténosée si la Vmax du flux E est > 1.7 m/s, le gradient moyen ≥ 6 mmHg et le Pt1/2 ≥ 230 msec. L'équation de continuité permet de calculer la surface d'ouverture en prenant comme référence le volume systolique dans la CCVG pour autant qu'il n'y ait aucune insuffisance valvulaire; en présence d'une IA et en l'absence d'IT, on peut utiliser la mesure du volume systolique dans la chambre de chasse du VD ou à travers la valve pulmonaire.
| Examen ETO après implantation de prothèse valvulaire |
|
Conditions hémodynamiques normales (pression artérielle > 80 mmHg, volémie et fonction ventriculaire satisfaisantes)
Mouvements des 2 ailettes ou des 3 cuspides visibles dans le même plan
Fuites physiologiques (jets fins, intravalvulaires, extension < 2 cm)
Calcul des gradients (ΔPmax et ΔPmoy)
En position mitrale - Contraction de la paroi latérale
- Flux dans les veines pulmonaires
- Fuite aortique nouvelle
- Discordance patient-prothèse si S < 1.2 cm2/m2 ; si discordance sévère (S < 0.9 cm2/m2): révision immédiate en CEC
En position aortique - Mesure de la Vmax dans la CCVG et recherche de SAM (risque de sténose dynamique)
- Mesure de la Vmax dans la cavité ventriculaire
- Discordance patient-prothèse si S < 0.85 cm2/m2 ; si discordance sévère (S < 0.65 cm2/m2): révision immédiate en CEC
- Fuite mitrale nouvelle
- Flux coronarien (TC et CD)
- Si myectomie/myotomie de la CCVG : recherche de CIV
Fuite paravalvulaire significatives (à l’extérieur de l’anneau valvulaire)
- Passage visible autour de la valve (prothèse mitrale : balayage 0-180° en position rétro-cardiaque, prothèse aortique : court-axe 40°)
- Jet de forme et de direction variable (≥ 2-3 cm)
- PISA côté d’amont
- Largeur du jet ≥ 0.3 cm
Une obstruction dynamique de la CCVG par déplacement en avant du feuillet mitral antérieur survient fréquemment lorsque certaines circonstances sont réunies :
- Levée de l'obstacle d'une sténose aortique (RVA)
- Plastie mitrale restrictive (anneau très réducteur)
- Diminution de la cavité du VG (hypovolémie, HVG concentrique sévère)
- Baisse de postcharge (vasoplégie, CPIA)
- Excès de stimulation catécholaminergique β
|
© CHASSOT PG, BETTEX D, Août 2011, dernière mise à jour Août 2018
Références
- BACH DS. Transesophageal echocardiographic (TEE) evaluation of prosthetic valves. Cardiol Clin 2000; 18:751-64
- BAX JJ, DELGADO V. Advanced imaging in valvular heart disease. Nat Rev Cardiol 2017; 14:209-23
- BURSTOW DJ, NISHIMURA RA, BAILEY KR, et al. Continuous wave Doppler echocardiographic measurement of prosthetic valve gradients. A simultaneous Doppler-catheter correlative study. Circulation 1989; 80:504-11
- FERNANDES V, OLMOS L. NAGUEH SF, et al. Peak early diastolic velocity rather than pressure half-time is the best index of mechanical prosthetic mitral valve function. Am J Cardiol 2002; 89:704-10
- FRANK M, GANZONI G, STARCK C, et al. Lack of accessible data on prosthetic heart valves. Int J Cardiovasc Imaging 2016; 32:439-47
- KARCHMER AW LONGWORTH DL. Infections of intracardiac devices. Infect Dis Clin North Am 2002; 16:477-89
- MAHMOOD F, MATYAL R, MAHMOOD F, et al. Intraoperative echocardiographic assessment of prosthetic valve: a practical approach. J Cardiothorac Vasc Anesth 2018; 32:823-37
- OH JK, SEWARD JB, TAJIK AJ. The echo manual. 3rd edition. Philadelphia, Lippincott Williams & Wilkins, 2006, 189-242
- PIBAROT P, DUMESNIL JG. Prosthetic heart valves: selection of the optimal prosthesis and long-term management. Circulation 2009; 119:1034-48
- RAJANI R, MUKHERJEE D, CHAMBERS JB. Doppler echocardiography in normally-functioning replacement aortic valve: a review of 129 studies. J Hesart Valve Dis 2007; 16:519-35
- STEWART SF, NAST EP, ARABIA FA, et al. Errors in pressure gradient measurement by continuous wave Doppler ultrasound: type, size ande age effects in bioprosthetic aortic valves. J Am Coll Cardiol 1991; 18:769-79
- VAHANIAN A, ALFIERI O, ANDREOTTI F, et al. Guidelines on the management of valvular heart disease (version 2012). The Joint Task Force on the Management of Valvular Heart Disease of the European Society of Cardiology (ESC) and the European Association for Cardio-Thoracic Surgery (EACTS). Eur Heart J 2012; 33:2451-96
- ZABALGOITIA M. Echocardiographic assessment of prosthetic heart valves. Curr Probl Cardiol 2000; 25:157-66
- ZOGHBI WA, ADAMS D, BONOW RO, et al. Recommendations for noninvasive evaluation of native valvular regurgitation: a report from the ASE developed in collaboration with the SCMR. J Am Soc Echocardiogr 2017; 30:303-71
- ZOGHBI WA, CHAMBERS JB, DUMESNIL JG, et al. Recommendations for evaluation of prosthetic valves with echocardiography and Doppler ultrasound. J Am Soc Echocradiogr 2009; 22:975-1014
11. Anesthésie et valvulopathies
- 11.1 Introduction : prévalence et risques des valvulopathies
- 11.2 Rappel physiopathologique général
- 11.3 Imagerie valvulaire
- 11.4 Situations particulières
- 11.5 Chirurgie valvulaire
- 11.6 Insuffisance mitrale
- 11.6.1 Etiologie de l'insuffisance mitrale
- 11.6.2 Physiopathologie
- 11.6.3 Manifestations cliniques
- 11.6.4 Echocardiographie de l'insuffisance mitrale
- 11.6.5 Indications et résultats opératoires
- 11.6.6 Principes pour l'anesthésie
- 11.6.7 CEC et post CEC
- 11.6.8 IM primaire sur maladie de Barlow
- 11.6.9 IM secondaire sur ischémie myocardique
- 11.6.10 IM secondaire sur défaillance du VG
- 11.7 Sténose mitrale
- 11.8 Sténose aortique
- 11.8.1 Nosologie
- 11.8.2 Physiopathologie
- 11.8.3 Manifestations cliniques
- 11.8.4 Echocardiographie de la sténose aortique
- 11.8.5 Indications et résultats opératoires
- 11.8.6 Principes pour l'anesthésie en chirurgie cardiaque
- 11.8.7 CEC et post-CEC
- 11.8.8 Sténose sous-aortique dynamique
- 11.8.9 Anesthésie pour la chirurgie non-cardiaque
- 11.9 Insuffisance aortique
- 11.10 Maladie aortique
- 11.11 Pathologie tricuspidienne
- 11.12 Pathologie de la valve pulmonaire
- 11.13 Polyvalvulopathies
- 11.14 Conclusions